Главная
Общие понятия
Гидролиз по катиону
Гидролиз по аниону
Гидролиз по катиону и аниону
Необратимый гидролиз
Реакции обмена
Электролиты
Алгоритм написания уравнений гидролиза
Факторы, влияющие на гидролиз
Практическое применение
Проверь себя
Контроль |
Электролиты
Электролиты - вещества, способные диссоциировать на ионы в водных растворах и расплавах.
Сильные электролиты:
- кислоты: H2SO4, HCl, HNO3, HClO4, HBr, HI, HCSN, HMnO4
- основания: LiOH, KOH, NaOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2,
Сильные кислоты и сильные основания диссоциируют в растворах на ионы полностью.
HCl = Н+ + Сl - KOH = K+ + OH -
HNO3 = Н+ + NO3- NaOH = Na+ + OH -
Слабые электролиты:
- кислоты: H2SO3, H2СO3, HF, HNO2, HClO, H2S, CH3COOH, HCN.
- основания: NH4OH и все, кроме гидроксидов щелочных и щелочноземельных металлов.
Cлабые основания обычно не растворимы. NH4OH исключение - слабое, неустойчивое: NH4OH 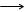 NH3+H2O. NH3+H2O. |

