Главная
Общие понятия
Гидролиз по катиону
Гидролиз по аниону
Гидролиз по катиону и аниону
Необратимый гидролиз
Реакции обмена
Электролиты
Алгоритм написания уравнений гидролиза
Факторы, влияющие на гидролиз
Практическое применение
Проверь себя
Контроль |
Гидролиз по катиону и аниону
(соль образованна слабым основанием и слабой кислотой)
Катион слабого основания и анион слабой кислоты взаимодействует с водой:
- среда раствора зависит от относительной силы кислоты и основания.
- n=1 образуются молекулы слабого основания и слабой кислоты, например, NH4СN, CH3COONH4
Например, для соли NH4СN ионное уравнение: NH4+ + СN- + H+ОН- 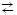 NH4OH + НСN. NH4OH + НСN.
среда раствора будет слабощелочной, рН = 7-8, так как Кд(NH4OH) = 6,3•10-5 > Кд(НСN) = 6,2•10-10.
- n=1 и >1 образуются гидроанионы и слабое основание, или гидроксокатионы и слабая кислота, например,
(NH4)2CO3 , Zn(NO2)2
- Гидролиз соли,образованной однозарядным катионом и многозарядным анионом протекает преимущественно, с образованием кислой соли.
Например, для соли (NН4)2СО3 ионное уравнение: NH4+ + СО32- + H+ОН- 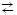 NH4OH + НСО3- NH4OH + НСО3-
- Гидролиз соли,образованной многозарядным катионом и однозарядным анионом протекает преимущественно, с образованием основной соли.
Например, для соли Zn(NO2)2 ионное уравнение: Zn2+ + NO2- + H+ОН- 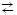 ZnОН+ + HNО2 ZnОН+ + HNО2
|

